丙烯酸丁酯废水为典型的高含盐有毒有机废水,目前有应用的污水处理技术主要包括焚烧法、湿式氧化法和生物法等。但由于该废水含盐量高,容易造成焚烧和湿式氧化处理设备结垢、腐蚀,而采用生物法处理存在处理负荷低、占地面积大等问题。
前期研究结果表明,丙烯酸丁酯废水中的污染物主要为丙烯酸盐、对甲基苯磺酸盐等有机盐类,采用双极膜电渗析技术可将废水中有机酸盐转化为有机酸和碱,实现对有机酸盐的回收利用和污染物的大幅度削减〔1〕。由于废水中除含有Na+外还含有Ca2+等多价阳离子,且以Ca2+浓度最高,会对双极膜电渗析系统的稳定运行产生不利影响(料液多价离子质量浓度需小于1 mg/L)〔2〕,需要预先选择性去除废水中的Ca2+。
螯合树脂是一类能与金属离子形成多配位络合物的离子交换材料,可选择性吸附多价离子〔3〕。氨基膦酸型螯合树脂对Ca2+、Mg2+的选择性较好,是理想的盐水软化树脂〔4〕,常用于双极膜电渗析料液中多价离子的去除。尽管氨基膦酸树脂对水中Ca2+的吸附已有研究,但由于离子交换过程受离子交换树脂和废水特性影响较大,因此笔者通过静态试验考察了螯合树脂对丙烯酸丁酯废水中Ca2+的吸附性能。
1 试验材料和方法
1.1 试验水质
试验用废水为某石化厂丙烯酸丁酯生产废水,先后经混凝沉淀和0.45 μm 滤膜过滤以去除悬浮颗粒物,处理后的废水pH 5.0~6.0,COD 8 万~10 万mg/L,废水中Ca2+质量浓度约为17~30 mg/L。
1.2 试验仪器、材料与分析方法
仪器:pHS-25 pH 测定仪,上海智光仪器仪表有限公司;AA-6300 原子吸收分光光度计,日本岛津公司;DHZ-ZA 恒温振荡器,太仓市实验设备厂;HZ-9212S 恒温振荡器,太仓市科教器材厂;Millipore-Q Plus 超纯水系统,美国Millipore 公司。
材料:C-900 螯合树脂(西安电力树脂厂),此树脂的交换容量2.07 mmol/g,湿树脂含水率31%;无水CaCl2 ( 分析纯);NaOH ( 分析纯); 镧溶液(0.1g/mL);硝酸溶液(1+1)。
钙离子的测定方法:原子吸收分光光度法〔5〕。
1.3 试验方法
1.3.1 树脂预处理
树脂使用前用70~80 ℃的热水浸洗,除去树脂中的低聚物、有害离子等杂质,浸洗至浸洗水不带褐色、泡沫很少为止。再先后用3~4 倍树脂体积的4%HCl、4%NaOH 浸泡1.5~2 h,用水冲洗至接近中性,置于超纯水中备用。
1.3.2 反应时间对离子交换的影响
试验采用摇瓶法〔6〕。称取1 g 预处理后的湿树脂于锥形瓶中,加入50 mL 废水(pH=8),25 ℃恒温振荡,转速为150 r/min,定时取样,分析计算吸附量,绘制时间-吸附量曲线。
1.3.3 pH 对离子交换的影响
分别取50 mL 废水,用HCl、NaOH 调节pH 为2.0、4.0、6.0、7.0、8.0、10.0、12.0,投加相同量预处理后的湿树脂,25 ℃恒温振荡30 min(150 r/min),取样分析,计算吸附量。
1.3.4 吸附剂用量对离子交换的影响
分别称取预处理后的湿树脂0.1、0.2、0.5、1、2 g于锥形瓶中,加入50 mL 废水(pH=8),25 ℃恒温摇床振荡30 min,取样分析,计算去除率和吸附量。
1.3.5 温度对离子交换的影响
向废水中投加不同量的Ca2+使其中的钙离子质量浓度分别达到60、80、100、160、200 mg/L,调废水pH=8,添加等量预处理后的树脂,分别在25、35、45、55 ℃水浴中恒温振荡30 min,取样分析,计算吸附量并绘制吸附等温线。
1.3.6 吸附量计算
计算树脂吸附量〔7, 8〕:
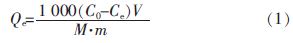
式中:Qe———树脂吸附量,μmol/g;
C0———吸附前废水中 Ca2+质量浓度,mg/L;
Ce———吸附后废水中 Ca2+质量浓度,mg/L;
V———废水体积,L;
M———离子的摩尔质量,g/mol;
m———湿树脂质量,g。
2 结果与讨论
2.1 反应时间的影响
螯合树脂对Ca2+吸附量随反应时间的变化如图 1 所示。
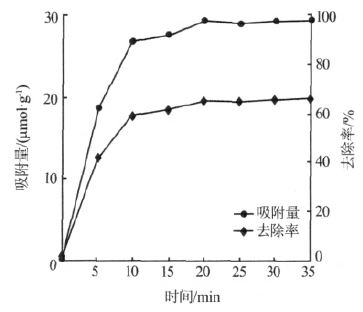
图 1 吸附量随反应时间变化
由图 1 可知,树脂对Ca2+的离子交换吸附与反应时间有关,先快后慢,前10 min 对Ca2+的去除率可达89%,20 min 之后吸附量变化缓慢,30 min 后,树脂对Ca2+的去除率达97%,达到平衡状态,因此后续研究中离子交换的反应时间均为30 min。
2.2 pH 的影响
pH 是影响树脂静态吸附行为的重要因素,研究不同pH 条件下树脂吸附量的变化有利于提高离子交换树脂的利用率〔9〕。螯合树脂在不同pH 条件下对Ca2+的吸附量如图 2 所示。
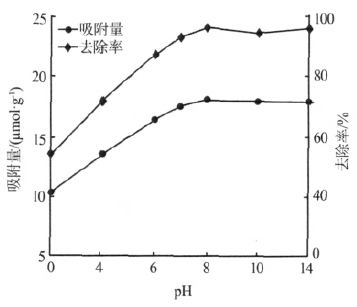
图 2 pH 对Ca2+吸附量的影响
由图 2 可知,废水pH 对螯合树脂的Ca2+吸附量有很大影响。由于氨基磷酸电离常数pK1和pK2分别为1.9~2.2 和7.5~8.0 〔10〕,因此,当废水pH<8时,废水中的H+与Ca2+竞争离子交换位点,随着pH的升高Ca2+的平衡吸附量逐渐增加; 当pH>8 时废水中H+浓度较低,对离子交换过程的影响较小。由于实际废水呈弱酸性,因此,试验条件下确定最佳吸附pH 为7~8,后续试验在此pH 下进行。
2.3 树脂用量对吸附的影响
树脂用量对Ca2+吸附量的影响如图 3 所示。
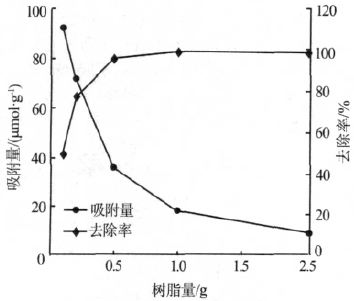
图 3 树脂用量对Ca2+吸附量的影响
由图 3 可知,随着树脂用量的增加,离子交换位点增多,Ca2+的去除率提高。同时,由于过多的树脂导致树脂表面未饱和的吸附位点增多,树脂吸附量随树脂量的增加而降低〔11〕。当树脂量大于1 g 时,Ca2+的去除率变化不大,可达99%左右。
2.4 温度的影响
25、35、45、55 ℃下螯合树脂对Ca2+的离子交换等温线如图 4 所示。
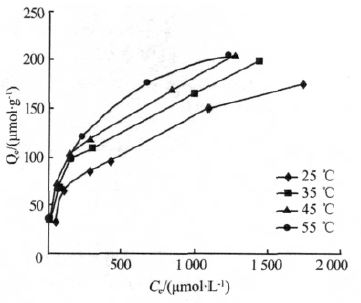
图 4 螯合树脂对Ca2+的吸附等温线
由图 4 可知,螯合树脂对Ca2+的平衡吸附量随温度升高而增加。与刘步云等〔5〕的研究结果一致。利用Langmuir 等温吸附模型对图 4 的试验数据进行拟合,其线性形式如式(2)所示〔12〕:
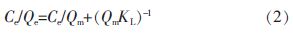
式中:Qm———树脂理论最大吸附量,μmol/g;
KL———Langmuir 吸附平衡常数,L/μmol。
拟合结果如表 1 所示。
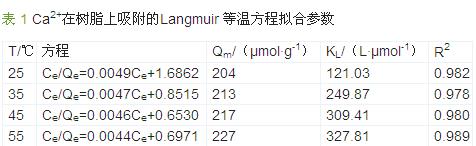
通过表 1 可知,螯合树脂对Ca2+的吸附符合Langmuir 模型,即为单分子层吸附。且随着温度的增加,最大吸附量Qm略有增加,平衡常数KL显著增加,表明随着温度的升高,离子交换树脂对Ca2+的亲和力提高〔13〕。用NaCl 和CaCl2配制模拟废水,Na+含量与实际废水相近,C-900 树脂对其中Ca2+在35 ℃下的吸附等温线如图 5 所示。
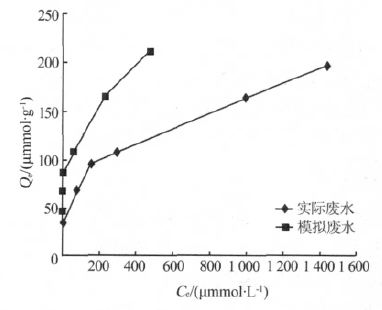
图 5 C-900 对实际废水和模拟废水中Ca2+的吸附等温线
由图 5 可知,在只有Na+的模拟水中,Ca2+吸附量随废水中Ca2+浓度的增加较快,而在实际废水中存在其他物质的影响,如废水中存在聚丙烯酸盐,可对Ca2+产生螯合作用,吸附量随浓度的增加较慢。同等浓度下,树脂对模拟废水中Ca2+的吸附量明显高于实际废水。模拟废水等温吸附方程为Ce/Qe=0.004 7Ce+0.140 7,Qm=213 μmol/g,KL=1 512 L/μmol。可以看出,35 ℃下模拟废水的Qm与实际废水相同,但KL明显较高。这是由于实际废水中存在的其他污染物对Ca2+的吸附过程产生了影响,如废水中少量聚丙烯酸对Ca2+的螯合作用以及其他离子的影响。
平衡系数常用于表征离子交换树脂对两种离子的相对选择性。Ca2+对Na+的平衡系数〔10〕:
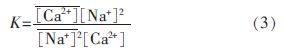
式中:、———分别为树脂上 Ca2+和 Na+吸附量,μmol/g;
〔Ca2+〕、〔Na+〕———分别为溶液中 Ca2+和 Na+浓度,μmol/L。
不同温度下Ca2+对Na+的平衡系数如图 6 所示。
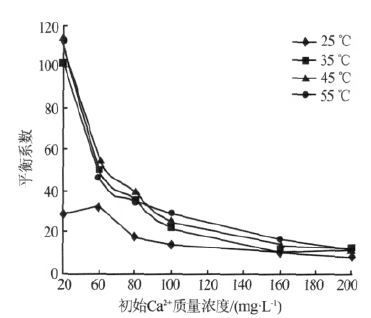
图 6 不同温度下平衡系数的变化
由图 6 可知,在同一Ca2+初始浓度下随着温度升高,平衡系数增大,特别是25~35 ℃,平衡系数大幅增加,表明随着反应温度的增加,螯合树脂对Ca2+的选择性提高,有利于废水中Ca2+的选择性去除。
3 结论
试验研究了C-900 螯合树脂对Ca2+的吸附性能,考察了反应时间、pH、树脂投加量、温度对离子交换过程的影响,结果表明:
(1)pH 对离子交换过程影响较大,pH 在7~8 以上时有利于Ca2+的吸附。
(2)温度对Ca2+的平衡吸附量以及树脂对Ca2+的选择性具有重要影响,同等条件下,温度越高树脂的平衡吸附量越大,树脂对Ca2+的选择性越强。
(3)丙烯酸丁酯废水中的其他污染物对Ca2+的离子交换有很大影响,与NaCl 和CaCl2模拟废水相比,螯合树脂对实际废水中Ca2+的选择性下降。









